两面性,是事情亘古不变的真理。
不少研究显示,PD-L1 表达阴性的 NSCLC 患者也可从免疫治疗中获益。那问题来了,PD-L1 表达真的可作为 NSCLC 治疗决策的「眼睛」吗?
PD-L1 检测对决策 NSCLC 的治疗意义之多少?
如果说靶向治疗是「精准扶贫」,那么可以说免疫治疗使肺癌治疗走向了「共同富裕」。但是共同富裕也有短板,其中一点就是缺乏可以识别「贫困人群」的特异性标记分子。
目前认为肿瘤组织 PD-L1 的表达是选择抗 PD-1/PD-L1 治疗优势人群比较合理的标志物。帕博利珠单抗治疗 NSCLC 的相关临床研究表明,PD-L1 的表达与临床疗效显著相关[1]。而纳武利尤单抗在 NSCLC 中的研究却发现,免疫治疗临床获益与 PD-L1 表达水平并不相关[2,3]。
那么 PD-L1 检测对于肺癌治疗决策的制定,其价值究竟有多大?是无关紧要还是至关重要?
观点 1:PD-L1 检测对 NSCLC 治疗无关紧要
此观点的产生主要基于以下 4 点:
➣ 依据 1:临床研究结果表明,PD-L1 表达与临床疗效无关
纳武利尤单抗治疗 NSCLC 的 CheckMate063 及 CheckMate017 研究发现,无论采取何种判读标准(≥ 1%,≥ 5%,或 ≥ 10%),PD-L1表达均与临床疗效无关[2,3]。
入组了 6 个随机对照临床研究、1,432 例 NSCLC 患者的 meta 分析显示,在 NSCLC 的免疫治疗中,PD-L1 表达与 PFS 及 OS 均不相关[4]。
➣ 依据 2:免疫治疗疗效受其他基因改变影响
NSCLC 患者合并 EGFR 突变、ALK 融合、STK11/LKB1 基因改变时,免疫治疗疗效欠佳[5]。
➣ 依据 3:PD-L1 表达具有异质性
单个部位及单次取材不能准确反应 PD-L1 表达情况:PD-L1 表达水平与肿瘤转移部位、既往治疗相关。
一项研究检测了 1,398 肺癌组织中 PD-L1 的表达,研究发现,肾上腺、肝脏及淋巴结转移瘤组织中 PD-L1 表达较高,而在骨及脑转移瘤组织中表达较低;其中 112 例患者接受治疗后进行了重复检测,55 例患者 PD-L1 表达发生了改变,其中接受免疫治疗的患者 PD-L1 的表达明显下降;
对 398 例晚期 NSCLC 患者 PD-L1 表达与预后的相关性进行分析显示,肺原发灶及远处转移病灶的 PD-L1 表达与高应答率、长 PFS 及 OS 相关,而淋巴结 PD-L1 的表达与应答率及生存无关[6]。
➣ 依据 4:无论 PD-L1 表达如何都可以获益
在免疫 2.0 的时代,无论是免化联合的 KEYNOTE189 研究[7],还是免免联合的CheckMate227 研究[8],均表明,无论 PD-L1 表达如何,患者均可从免疫联合治疗中获益。
因此,免疫治疗效果受到多种因素的影响,并且 PD-L1 的表达存在不均一性,并且是动态变化的,仅 PD-1 检测并不能很好的预测免疫疗效,尤其对于采用免疫联合治疗的患者,PD-L1 检测对免疫疗效的预测作用更加微弱。
观点 2:PD-L1 检测对 NSCLC 治疗至关重要
此观点的产生主要基于以下 3 点:
➣ 依据 1:临床研究结果显示,PD-L1 的表达与临床疗效显著相关
KEYNOTE 多项研究结果发现,PD-L1 高表达的 NSCLC 患者从帕博利珠单抗中获益最大,特别是 PD-L1 表达 > 50% 的患者,客观缓解率(ORR)、中位无进展生存(PFS)、总生存(OS)显著优于 < 50% 的群体(图 1)[7]。

图 1. 不同 PD-L1 表达的患者,PFS 不同
CheckMate057 研究表明,PD-L1 阳性患者的 ORR、PFS 及 OS 均高于阴性患者[9]。
POLAR 研究提示,在阿替利珠单抗治疗中,PD-L1 阳性患者具有更长的 OS[10]。
一项纳入了 14 个临床研究的 meta 分析显示,PD-L1 阳性患者的 ORR 显著高于阴性患者(27.6% vs 12.1%),并且与 PFS 及 OS 相关[11]。
➣ 依据 2:PD-L1 检测已经写进了肺癌 NCCN 指南和 CSCO 指南(图 2 和图 3)。

图 2. NCCN 指南推荐在一线免疫治疗前,需进行 PD-L1 检测
CSCO 非小细胞肺癌诊疗指南(2020)版推荐:帕博利珠单抗作为一线治疗时,需行PD-L1检测[12]。

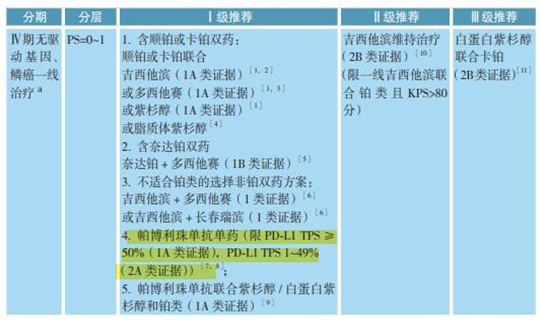
图 3. 2020 CSCO 指南中,在对于无驱动基因 NSCLC 患者进行帕博利珠单抗作为一线治疗时,需行 PD-L1 检测(左图:非鳞癌,右图:鳞癌)
➣ 依据 3:检测方式多样性及肿瘤异质性会导致产生不同的检测结果
检测方式多样性:不同的药物研究采用了不同的检测抗体,即使帕博利珠单抗相关的 KEYNOTE 系列研究,对 PD-L1 的表达也采用了不同的分层标准[1]。同一标本采用不同的检测方法可能产生不同的检测结果。
肿瘤本身具有异质性:当 PD-L1 检测提示阴性时,有可能是取材没有取到阳性区域。另外,标本冷缺血时间、固定剂的数量及质量、固定时间、储存条件、蜡块的存储时间、判读者水平均会影响结果判读[13]。
其他标记物探索不尽人意,PD-L1 虽不完美但无可替代
既然 PD-L1 作为 NSCLC 免疫治疗的标记分子并不完美,人们在不断探索其他标记分子,如 CTLA4、CX3CL1、Tim-3、LAG-3、TMB、MMR、MSI 等[14]。但结果均不尽人意。
其中 TMB 研究较多,提示高 TMB 的患者可能从免疫治疗得到更多获益,但缺乏前瞻性研究结果,对于高 TMB 的判定目前也没有明确的 cut-off 值,在应用层面尚未形成共识。
就目前来说,PD-L1 仍是预测 NSCLC 患者免疫疗效最靠谱的标记分子。
随着对 PD-L1 检测标准的统一及 PD-1/PD-L1 通路深入研究,联合基因检测、血清标记物的检测,更多的生物标志物也将被不断的发现,我们期待更完美的生物标志物或标记物组合。
小调研
PD-L1 检测对 NSCLC 的治疗决策价值,您认为:
A.非常重要,治疗前的必做检测
B.指示意义不大,不必做
C.尚需统一检测标准的进一步研究
亮点概述

内容策划:ATCG
内容审核:ATCG
插图/题图来源:出自文献、站酷海洛
相关文章
- 中性粒细胞缺乏但不伴发热,要用抗菌药物吗?
- 3 分钟掌握肿瘤动态:血液 NGS 可为 ALK 阳性 NSCLC 提供临床决策;III 期结肠癌肿瘤沉积为阴性预后因素
- 祥细观察软骨肉瘤
- 免疫治疗超进展,什么指标能预测?哪些患者是高危?
- 曲妥珠单抗的 5 大使用注意事项,千万别踩坑!
- 三阴性乳腺癌 14 大治疗靶点盘点,还有哪个你不知道?
- 新型口服 SERD 药物可将 HR+ 乳腺癌的死亡风险降低 30% | SABCS 乳腺癌研讨会
- HPV 相关的口咽癌患者是否可调整区域内放射范围和剂量?
- 胃肠道间质瘤的诊治 & 随访,看看最新国外指南如何规范!
- OS、PFS、DFS 有什么区别? 6 大肿瘤临床试验终点全解读




发表评论: